Решение связанных краевых задач механохимии — различия между версиями
Polina (обсуждение | вклад) |
Polina (обсуждение | вклад) |
||
| Строка 4: | Строка 4: | ||
== Введение и описание проблемы == | == Введение и описание проблемы == | ||
| − | Проблема окисления кремния сегодня является одной из важнейших проблем в химии в связи с широким использованием и значимостью технологии кремниевых интегральных схем. Так как объем молекулы диоксида кремния примерно в 2.3 раза больше атома кремния, окисление кремния сопровождается увеличением объема, порождающим внутренние деформации и напряжения. Кроме того, зачастую химическая реакция проходит также и под приложенными внешними механическими нагрузками. Это значит, что задача скорости роста превращенного слоя и распространения фронта химической реакции не может не учитывать механические напряжения. | + | Проблема окисления кремния сегодня является одной из важнейших проблем в химии в связи с широким использованием и значимостью технологии кремниевых интегральных схем. Так как объем молекулы диоксида кремния примерно в 2.3 раза больше атома кремния, окисление кремния сопровождается увеличением объема, порождающим внутренние деформации и напряжения. Кроме того, зачастую химическая реакция проходит также и под приложенными внешними механическими нагрузками. Это значит, что задача скорости роста превращенного слоя и распространения фронта химической реакции не может не учитывать механические напряжения. |
| + | |||
В классической химии скорость реакции определяется химическим сродством реакции, которое является комбинацией химических потенциалов участвующих в химической реакции компонент: | В классической химии скорость реакции определяется химическим сродством реакции, которое является комбинацией химических потенциалов участвующих в химической реакции компонент: | ||
<math>A = - \sum n_k M_k \mu_k,</math> | <math>A = - \sum n_k M_k \mu_k,</math> | ||
где <math>\mu_k</math> - относительный (на единицу массы) химический потенциал k-той компоненты, <math>M_k</math> - молярная масса, стохиометрический коэффициент <math>n_k</math> входит в сумму со знаком “+”, если k-тая компонента производится в результате реакции, и со знаком “-”, если расходуется. Химическое сродство широко используется в термодинамической теории химических реакций. В частности, кинетическое уравнение было сформулировано в следующем виде: | где <math>\mu_k</math> - относительный (на единицу массы) химический потенциал k-той компоненты, <math>M_k</math> - молярная масса, стохиометрический коэффициент <math>n_k</math> входит в сумму со знаком “+”, если k-тая компонента производится в результате реакции, и со знаком “-”, если расходуется. Химическое сродство широко используется в термодинамической теории химических реакций. В частности, кинетическое уравнение было сформулировано в следующем виде: | ||
<math>\omega = k_* c \left\{ {1 - \exp \left( { - \frac{{{A}}}{{RT}}} \right)} \right\}.</math> | <math>\omega = k_* c \left\{ {1 - \exp \left( { - \frac{{{A}}}{{RT}}} \right)} \right\}.</math> | ||
| − | Здесь <math>\omega</math> - скорость химической реакции, <math>k_*</math> - кинетическая константа (параметр реакции), <math>R = 8.31 \mathrm{JK^{-1}mol^{-1}}</math> - универсальная газовая постоянная, T - температура, <math>c</math> - молярная концентрация газовой компоненты реакции. | + | Здесь <math>\omega</math> - скорость химической реакции, <math>k_*</math> - кинетическая константа (параметр реакции), <math>R = 8.31 \mathrm{JK^{-1}mol^{-1}}</math> - универсальная газовая постоянная, T - температура, <math>c</math> - молярная концентрация газовой компоненты реакции. |
| − | В случае химических реакций в газах и жидкостях, где напряжения определяются скалярной величиной - давлением, химический потенциал также является скалярной величиной. В случае твердых реагирующих компонент химический потенциал становится тензором. В результате изучения фазового равновесия, было показано, что тензор химического потенциала для твердой компоненты определяется тензором энергии-импульса Эшелби. В работе (1) выражение для тензора химического сродства было получено как результат анализа уравнений баланса массы, импульса и энергии, а также неравенства энтропии, которое было записано для химической реакции между газовой и твердыми компонентами произвольной реологии. А именно, в диссипативном неравенстве для химической реакции было показано, что скорость реакции на ориентированной площадке с нормалью <math>\boldsymbol{n}</math> сопряжена с нормальной компонентой <math>\boldsymbol{A_{nn}} = \boldsymbol{n \cdot A \cdot n}</math> тензора <math>\boldsymbol{A}</math>, который и приняли за тензор химического сродства. | + | |
| − | Итак, влияние механических нагрузок на рост превращенного слоя и, соответственно, на распространения фронта химической реакции, может быть учтено несколькими способами: через вышеописанную зависимость химического сродства от напряжений, или через зависимость кинетической константы (параметра реакции) от напряжений. Помимо влияния на термодинамику, механические нагрузки также влияют и на диффузию газовой компоненты, и, соответственно, на ее концентрацию, которая входит в выражение для скорости химической реакции. Существуют различные способы представления зависимости диффузии от механических напряжений. В некоторых работах механические нагрузки учитываются через зависимость коэффициента диффузии от напряжений, эта зависимость является эмпирической. В некоторых работах механические нагрузки вводятся дополнительным членом, зависящим от напряжений, в закон Фика. Однако чаще всего при рассмотрении химических реакций под механическими нагрузками зависимость диффузии от напряжений не учитывается, и берется постоянное значение коэффициента диффузии. | + | В случае химических реакций в газах и жидкостях, где напряжения определяются скалярной величиной - давлением, химический потенциал также является скалярной величиной. В случае твердых реагирующих компонент химический потенциал становится тензором. В результате изучения фазового равновесия, было показано, что тензор химического потенциала для твердой компоненты определяется тензором энергии-импульса Эшелби. В работе (1) выражение для тензора химического сродства было получено как результат анализа уравнений баланса массы, импульса и энергии, а также неравенства энтропии, которое было записано для химической реакции между газовой и твердыми компонентами произвольной реологии. А именно, в диссипативном неравенстве для химической реакции было показано, что скорость реакции на ориентированной площадке с нормалью <math>\boldsymbol{n}</math> сопряжена с нормальной компонентой <math>\boldsymbol{A_{nn}} = \boldsymbol{n \cdot A \cdot n}</math> тензора <math>\boldsymbol{A}</math>, который и приняли за тензор химического сродства. |
| + | |||
| + | Итак, влияние механических нагрузок на рост превращенного слоя и, соответственно, на распространения фронта химической реакции, может быть учтено несколькими способами: через вышеописанную зависимость химического сродства от напряжений, или через зависимость кинетической константы (параметра реакции) от напряжений. Помимо влияния на термодинамику, механические нагрузки также влияют и на диффузию газовой компоненты, и, соответственно, на ее концентрацию, которая входит в выражение для скорости химической реакции. Существуют различные способы представления зависимости диффузии от механических напряжений. В некоторых работах механические нагрузки учитываются через зависимость коэффициента диффузии от напряжений, эта зависимость является эмпирической. В некоторых работах механические нагрузки вводятся дополнительным членом, зависящим от напряжений, в закон Фика. Однако чаще всего при рассмотрении химических реакций под механическими нагрузками зависимость диффузии от напряжений не учитывается, и берется постоянное значение коэффициента диффузии. | ||
В этой работе предпринимается попытка предложить разумную и обоснованную зависимость коэффициента диффузии от механический напряжений, а именно - от деформаций скелета твердого тела, что ведет к модели тензодиффузии. Для различных краевых задач проводится вычисление кинетики продвижения фронта химической реакции в зависимости от приложенных внешних нагрузок с использованием модели тензорного химического сродства. Сравниваются результаты, полученные для предложенного коэффицента диффузии, для принятого эмпирического и для постоянного коэффициента, чтобы выяснить, как диффузия под напряжением влияет на распространение фронта химической реакции, исследовать, какой из коэффициентов диффузии оказывает более сильное влияние на процесс распространения фронта химической реакции, и получить значения внешних нагрузок, при которых зависимостью коэффициента диффузии от напряжений можно пренебречь и считать его постоянным. | В этой работе предпринимается попытка предложить разумную и обоснованную зависимость коэффициента диффузии от механический напряжений, а именно - от деформаций скелета твердого тела, что ведет к модели тензодиффузии. Для различных краевых задач проводится вычисление кинетики продвижения фронта химической реакции в зависимости от приложенных внешних нагрузок с использованием модели тензорного химического сродства. Сравниваются результаты, полученные для предложенного коэффицента диффузии, для принятого эмпирического и для постоянного коэффициента, чтобы выяснить, как диффузия под напряжением влияет на распространение фронта химической реакции, исследовать, какой из коэффициентов диффузии оказывает более сильное влияние на процесс распространения фронта химической реакции, и получить значения внешних нагрузок, при которых зависимостью коэффициента диффузии от напряжений можно пренебречь и считать его постоянным. | ||
| Строка 35: | Строка 38: | ||
</math> | </math> | ||
| − | где <math>{\boldsymbol{\sigma }}_{^ - }^{} = {{\bf{C}}_{^ - }}:{{\boldsymbol{\varepsilon }}_{^ - }}</math> и <math>{{\boldsymbol{\sigma }}_{^ + }} = {{\boldsymbol{C}}_{^ + }}:({{\boldsymbol{\varepsilon }}_{^ + }} - {{\boldsymbol{\varepsilon }}_{^{{\rm{ch}}}}})</math> - тензора напряжений Коши, <math>{{\boldsymbol{C}}_{^ \pm }}</math> являются тензорами жесткости упругих компонент, <math>{{\boldsymbol{\varepsilon }}_{^ \pm }}</math> - тензора деформации, <math>c(\Gamma )</math> - концентрация газа на фронте реакции, <math>c_*</math> - растворимость газовой компоненты в сформированном материале <math>B_ +</math>. Также мы относим деформации химических превращений к <math>{{\bf{\varepsilon }}_{^{{\rm{ch}}}}}</math> и считаем, что эти деформации изотропны в объеме, т.е. <math>{{ \boldsymbol{\varepsilon }}_{^{{\rm{ch}}}}} = {\varepsilon _{^{{\rm{ch}}}}}\boldsymbol{I}</math> , где <math>\boldsymbol{I}</math> - единичный тензор. Параметр <math>\gamma (T)</math> отвечает за отсчетные уровни химических энергий. Если температура <math>Т</math> дана, <math>\gamma (T)</math> является параметром модели | + | где <math>{\boldsymbol{\sigma }}_{^ - }^{} = {{\bf{C}}_{^ - }}:{{\boldsymbol{\varepsilon }}_{^ - }}</math> и <math>{{\boldsymbol{\sigma }}_{^ + }} = {{\boldsymbol{C}}_{^ + }}:({{\boldsymbol{\varepsilon }}_{^ + }} - {{\boldsymbol{\varepsilon }}_{^{{\rm{ch}}}}})</math> - тензора напряжений Коши, <math>{{\boldsymbol{C}}_{^ \pm }}</math> являются тензорами жесткости упругих компонент, <math>{{\boldsymbol{\varepsilon }}_{^ \pm }}</math> - тензора деформации, <math>c(\Gamma )</math> - концентрация газа на фронте реакции, <math>c_*</math> - растворимость газовой компоненты в сформированном материале <math>B_ +</math>. Также мы относим деформации химических превращений к <math>{{\bf{\varepsilon }}_{^{{\rm{ch}}}}}</math> и считаем, что эти деформации изотропны в объеме, т.е. <math>{{ \boldsymbol{\varepsilon }}_{^{{\rm{ch}}}}} = {\varepsilon _{^{{\rm{ch}}}}}\boldsymbol{I}</math> , где <math>\boldsymbol{I}</math> - единичный тензор. Параметр <math>\gamma (T)</math> отвечает за отсчетные уровни химических энергий. Если температура <math>Т</math> дана, <math>\gamma (T)</math> является параметром модели. |
Если мы заменим скалярную величину химического сродства нормальной компонентой тензора химического сродства, скорость на элементе поверхности с нормалью <math>\boldsymbol{n}</math> будет определяться выражением: | Если мы заменим скалярную величину химического сродства нормальной компонентой тензора химического сродства, скорость на элементе поверхности с нормалью <math>\boldsymbol{n}</math> будет определяться выражением: | ||
| Строка 78: | Строка 81: | ||
Первое условие следует из условия баланса массы на внешней границе тела <math>\Omega</math>, <math>\alpha</math> - константа скорости растворения молекул газа в новом материале. Второе условие следует из условия баланса массы на фронте реакции <math>\Gamma</math>. | Первое условие следует из условия баланса массы на внешней границе тела <math>\Omega</math>, <math>\alpha</math> - константа скорости растворения молекул газа в новом материале. Второе условие следует из условия баланса массы на фронте реакции <math>\Gamma</math>. | ||
| − | Определение коэффициента диффузии используется согласно | + | Определение коэффициента диффузии используется согласно. Коэффициент диффузии может быть подсчитан по следующей формуле: |
<math> | <math> | ||
D = {D_0}{e^{ - p{V_d}/kT}}, D < {D_{{\rm{max}}}} | D = {D_0}{e^{ - p{V_d}/kT}}, D < {D_{{\rm{max}}}} | ||
Версия 22:22, 14 июня 2017
МГИСТРСКАЯ РАБОТА
Автор работы: Григорьева Полина
Научный руководитель: Елена Вильчевская
Содержание
Введение и описание проблемы
Проблема окисления кремния сегодня является одной из важнейших проблем в химии в связи с широким использованием и значимостью технологии кремниевых интегральных схем. Так как объем молекулы диоксида кремния примерно в 2.3 раза больше атома кремния, окисление кремния сопровождается увеличением объема, порождающим внутренние деформации и напряжения. Кроме того, зачастую химическая реакция проходит также и под приложенными внешними механическими нагрузками. Это значит, что задача скорости роста превращенного слоя и распространения фронта химической реакции не может не учитывать механические напряжения.
В классической химии скорость реакции определяется химическим сродством реакции, которое является комбинацией химических потенциалов участвующих в химической реакции компонент: где - относительный (на единицу массы) химический потенциал k-той компоненты, - молярная масса, стохиометрический коэффициент входит в сумму со знаком “+”, если k-тая компонента производится в результате реакции, и со знаком “-”, если расходуется. Химическое сродство широко используется в термодинамической теории химических реакций. В частности, кинетическое уравнение было сформулировано в следующем виде: Здесь - скорость химической реакции, - кинетическая константа (параметр реакции), - универсальная газовая постоянная, T - температура, - молярная концентрация газовой компоненты реакции.
В случае химических реакций в газах и жидкостях, где напряжения определяются скалярной величиной - давлением, химический потенциал также является скалярной величиной. В случае твердых реагирующих компонент химический потенциал становится тензором. В результате изучения фазового равновесия, было показано, что тензор химического потенциала для твердой компоненты определяется тензором энергии-импульса Эшелби. В работе (1) выражение для тензора химического сродства было получено как результат анализа уравнений баланса массы, импульса и энергии, а также неравенства энтропии, которое было записано для химической реакции между газовой и твердыми компонентами произвольной реологии. А именно, в диссипативном неравенстве для химической реакции было показано, что скорость реакции на ориентированной площадке с нормалью сопряжена с нормальной компонентой тензора , который и приняли за тензор химического сродства.
Итак, влияние механических нагрузок на рост превращенного слоя и, соответственно, на распространения фронта химической реакции, может быть учтено несколькими способами: через вышеописанную зависимость химического сродства от напряжений, или через зависимость кинетической константы (параметра реакции) от напряжений. Помимо влияния на термодинамику, механические нагрузки также влияют и на диффузию газовой компоненты, и, соответственно, на ее концентрацию, которая входит в выражение для скорости химической реакции. Существуют различные способы представления зависимости диффузии от механических напряжений. В некоторых работах механические нагрузки учитываются через зависимость коэффициента диффузии от напряжений, эта зависимость является эмпирической. В некоторых работах механические нагрузки вводятся дополнительным членом, зависящим от напряжений, в закон Фика. Однако чаще всего при рассмотрении химических реакций под механическими нагрузками зависимость диффузии от напряжений не учитывается, и берется постоянное значение коэффициента диффузии.
В этой работе предпринимается попытка предложить разумную и обоснованную зависимость коэффициента диффузии от механический напряжений, а именно - от деформаций скелета твердого тела, что ведет к модели тензодиффузии. Для различных краевых задач проводится вычисление кинетики продвижения фронта химической реакции в зависимости от приложенных внешних нагрузок с использованием модели тензорного химического сродства. Сравниваются результаты, полученные для предложенного коэффицента диффузии, для принятого эмпирического и для постоянного коэффициента, чтобы выяснить, как диффузия под напряжением влияет на распространение фронта химической реакции, исследовать, какой из коэффициентов диффузии оказывает более сильное влияние на процесс распространения фронта химической реакции, и получить значения внешних нагрузок, при которых зависимостью коэффициента диффузии от напряжений можно пренебречь и считать его постоянным.
Постановка задачи: Модель и уравнения
Теория кинетики химических реакций основана на концепции химических потенциалов и химического сродства, которые являются линейной комбинацией химических потенциалов веществ, принимающих участие в реакции. В классической теории химический потенциал является скаляром. Однако этот подход действителен только для газов и жидкостей, но редко для твердых тел. Если мы хотим исследовать фазовый переход в деформируемых твердых материалах, нам нужно тензорное выражение для химического потенциала. Это также значит, что химическое сродство тоже станет тензором. В связи с проблемой, описанной в предыдущем разделе, мы рассмотрим химическую реакцию между твердой и газовой компонентами:
где и относятся к деформируемым твердым компонентам, а - к газовой компоненте. Мы считаем, что реакция сконцентрирована около фронта реакции, , который разделяет области, занятые и . Реакция проистекает и продолжается вследствие диффузии газовой компоненты сквозь образующуюся . Мы считаем, что весь газ, подходящий к фронту, будет израсходован в химической реакции. Как пример такой реакции, мы можем рассмотреть уравнение, описывающее образование диоксида кремния .
Мы считаем, что область, занятая , является проницаемой для газовой компоненты, которая может свободно диффузировать через твердую компоненту и не вызывать в ней никаких деформаций. Для простоты мы не учитываем эффекты внутреннего трения, влияние реакции на температуру, т.е. мы не реашем задачу теплопроводности, и считаем температуру параметром модели.
Было показано, что нормальная компонента тензора химического сродства может быть вычислена согласно следующей формуле (см.(1)):
где и - тензора напряжений Коши, являются тензорами жесткости упругих компонент, - тензора деформации, - концентрация газа на фронте реакции, - растворимость газовой компоненты в сформированном материале . Также мы относим деформации химических превращений к и считаем, что эти деформации изотропны в объеме, т.е. , где - единичный тензор. Параметр отвечает за отсчетные уровни химических энергий. Если температура дана, является параметром модели.
Если мы заменим скалярную величину химического сродства нормальной компонентой тензора химического сродства, скорость на элементе поверхности с нормалью будет определяться выражением:
где - скорость прямой химической реакции, является кинетической константой скорости химической реакции. Тогда из баланса массы на фронте реакции, , - нормальная компонента скорости распространения химического фронта, следует, что :
Фронт реакции продвигается, только если . Тогда из уравнения мы можем найти равновесную концентрацию на фронте реакции:
Вводя эту равновесную концентрацию, мы можем переписать вблизи химического равновесия как . Следовательно, мы можем переписать и формулу для скорости распространения реакции:
Концентрация газовой компоненты на фронте химической реакции может быть найденa из второго закона Фика для диффузии:
Мы считаем, что процесс диффузии не зависит от времени. Тогда уравнение принимает вид:
Граничными условиями являются:
Первое условие следует из условия баланса массы на внешней границе тела , - константа скорости растворения молекул газа в новом материале. Второе условие следует из условия баланса массы на фронте реакции . Определение коэффициента диффузии используется согласно. Коэффициент диффузии может быть подсчитан по следующей формуле: где за обозначено давление на фронте реакции, - температура системы, - объем, занимаемый молекулой, и - температурная постоянная Больцмана. Кроме того, величина , варьируется от 1.1 до 2 в зависимости от температуры. Итак, задача сводится к следующим пунктам: сначала мы находим . Далее, мы находим из задачи диффузии и затем, окончательно, подставляем полученные значения в формулу для нормальной компоненты скорости.
Решение для различных видов механических нагрузок
В этом разделе мы представим аналитическое решение задачи для простейшей геометрии. Станем рассматривать трехмерный прямоугольный параллелепипед: с реакцией, распространяющейся в направлении оси и фронтом реакции, представленным плоскостью . Считаем, что концентрация не зависит от координат и , поэтому , .
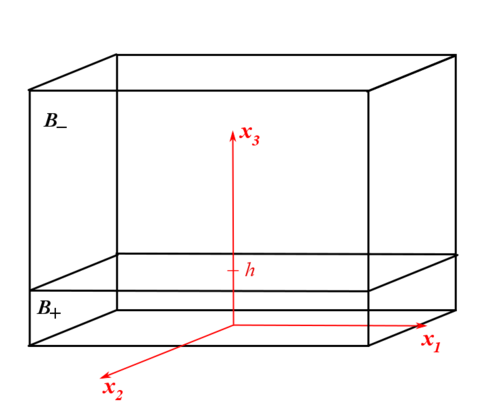
Будет изучено два случая механической нагрузки:
первый, перемещения на поверхности тела заданы, и второй, напряжения на поверхности заданы.
Считаем, что нам даны перемещения, которые приложены к телу следующим образом:
Тогда деформации равномерно распределены по всему телу:
Сдвиговые деформации отсутствуют, т.е. .
Считаем, что напряжения по оси отсутствуют, т.е. имеем дело с плосконапряженной задачей. Тогда из закона Гука можем вычислить оставшиеся напряжения и деформации:
Для региона "+":
Для удобства расчетов с значениями параметров конкретного материала перейдем к модулю Юнга, , и коэффициенту Пуассона, , и запишем выражение для функции напряжений, входящей в состав выражения для вычисления :
Реакция идет только при . Следовательно, при отсутствии внешних деформаций и при реакция может идти только при:
В этом случае выражение для коэффициента диффузии примет вид :
не зависит от координаты , поэтому уравнение диффузии примет вид:
Решением этого уравнения будет линейная функция . Из граничных условий можно найти константы и . В итоге, функция концентрации будет выглядеть следующим образом:
Подставляя полученное выражение в уравнение для скорости распространения реакции, окончательно получим:
В случае заданных усилий на поверхности можно найти напряжения , отвечающие условиям баланса сил и моментов:
Чтобы найти напряжения из закона Гука, сделаем предположение, что , и что .
Из-за условий неразрывности мы получим, что . В этом случае напряжения будут выглядеть следующим образом:
Константы можно найти из уравнений баланса. Функцию напряжений можно найти, заменив и на соответственно. При постоянном коэффициенте диффузии, проводя вычисления, аналогичные предыдущему пункту, получим, что . Если коэффициент диффузии зависит от напряжений, то в данном случае он принимает следующий вид:
Тогда задача диффузии запишется следующим образом:
Решением этого уравнения будет функция , с граничными условиями, которые будут выглядеть как:
Окончательно, концентрация будет выглядеть следующим образом:
Скорость в этом случае запишется согласно следующей формуле:
Результаты
Список литературы
1) Freidin, A.B., Vilchevskaya, E. N., Korolev, I. K.: Stress-assist chemical reactions front propagation in deformable solids. International Journal of Engineering Science, 83 (2014), pp. 57-75.
2) Prigogine, I., Defay, R.: Chemical thermodynamics. London: Longmans, Green, 1954.
3) Thermodynamic theory of structure, stability and fluctuation. Wiley Interscience, London, 1971, pg. 50.
4) Ming-Tzer Lin.: Stress effects and oxidant diffusion in the planar oxidation. (1999). Thesis and Dissertation, Lehigh University. Paper 594
5) B.E.Deal, A.S. Grove: General relationship for the thermal oxisation of Silicon. Journal of Applied Physics, vol.36(12), December 1965.